IDEXX Labor
TIEFERE EINBLICKE
Support und weitere Informationen zum IDEXX Labor
Kundenservice kontaktieren
069 153 253 290
Laborservice und medizinische Fachberatung | Kontakt- und Service (allgemein)
Antragsscheine
Haben Sie einen bestimmten Antragsschein gerade nicht zur Hand? Hier können Sie unsere Scheine zum Ausdrucken herunterladen. Bitte achten Sie bei der Druckqualität auf gute Lesbarkeit, damit die von Ihnen angeforderten Untersuchungen korrekt erfasst werden können. Schicken Sie unbedingt immer den vollständigen Schein ein, da wir die Angaben zum Patienten auf Seite 1 benötigen, auch wenn Sie nur Untersuchungen auf Seite 2 anfordern.
Wenn Sie bei Laboreinsendung die Möglichkeit nutzen, die Rechnung an den Tierhalter senden zu lassen, achten Sie bitte darauf, eine korrekte sowie aktuelle Adresse auf dem Antragsschein einzutragen. Bitten Sie auch den Tierhalter, die Adresse zu kontrollieren bevor dieser die Anforderung unterschreibt. Kann eine Rechnung aufgrund falscher Adresse nicht zugestellt werden und wird diese auch nicht an uns zurückgesandt, kommen Mahngebühren auf die Besitzer zu.
Noch einfacher geht es mit IDEXX VetConnect PLUS. Dort finden Sie für viele Untersuchungen auch zusätzliche Informationen, Angaben zu Differentialdiagnosen in den Befunden, Trendgrafiken und weitere Funktionen. Hier erfahren Sie mehr.
Tollwut-Antikörperbestimmung (ausfüllbares PDF)
Bitte beachten Sie: für die Ausstellung einer Bescheinigung über den Tollwut-Antikörpertiter muss der Antragsschein vollständig ausgefüllt werden. Bei unvollständigen Angaben können wir keine Titerbestimmung durchführen.
Geschlechtsbestimmung Vogel (ausfüllbares PDF)
Bestellungen für Probenversandmaterial
Schnell und einfach online bestellen – jetzt verfügbar unter „IDEXX Online-Bestellungen“
Bleiben Sie auf dem Laufenden über neue Produkte, Dienstleistungen und Fortbildungen
Eine Probe vorbereiten und einsenden
Die korrekte Verpackung des Probenmaterials gewährleistet eine gute Probenqualität bis zum Eintreffen im Labor sowie eine reibungslose Bearbeitung der Probe. Zudem verhindert sie Schwierigkeiten beim Transport und schützt alle Beteiligten vor Verletzungen und Infektionen. Wir stellen Ihnen für jedes Probenmaterial geeignete Verpackungsmaterialien zur Verfügung. Anfordern können Sie diese bei der Bestellannahme für Probenversandmaterial . Bei richtiger Verwendung sind die Proben damit gemäß der aktuellen Verpackungsrichtlinien geschützt und Sie kommen Ihrer Sorgfaltspflicht als Versender nach.
Viele Informationen rund um die von uns zur Verfügung gestellten Probenversandaterialien sowie die korrekte Verpackung haben wir in einem Leitfaden zur Präanalytik für Sie zusammengestellt.
Was sollte bei Probeneinsendung unbedingt vermieden werden?
Die Gesundheit unserer Mitarbeiter hat für uns höchste Priorität. Leider erreichen uns immer wieder Proben, die Kanülen, Skalpelle, Tackernadeln oder ähnliches enthalten und eine erhebliche Verletzungsgefahr darstellen. Gemäß unseren Allgemeinen Geschäftsbedingungen sehen wir uns gezwungen, solche Proben zu entsorgen und diese nicht zu untersuchen. Bitte achten Sie darauf, dass Ihre Proben sicher eingeschickt werden und kontrollieren Sie diese vor dem Versand auf eventuell darin verbliebene scharfe Materialien.
Wie soll ich vorgehen, wenn ich eine Probe für einen Test einsenden möchte, der nicht auf dem Antragsschein aufgeführt ist?
Bitte kontaktieren Sie IDEXX unter der Nummer 069 153 253 290. Im Labor sind zahlreiche zusätzliche Tests oder Spezialtests verfügbar.
Was soll ich tun, wenn ich nicht genug Blut für alle Tests erhalte, die ich für einen bestimmten Patienten anfordern möchte?
Bitte kontaktieren Sie das Labor unter der Nummer 069 153 253 290. Wir können Ihnen helfen, die Tests nach Prioritäten zu ordnen, oder Alternativen vorschlagen und Ihre Prioritäten auf dem Testanforderungsformular notieren.
Was soll ich tun, falls ich Fragen zur Einsendung einer Probe oder Beurteilung eines Ergebnisses habe?
Falls Sie die Antwort auf Ihre Frage nicht im FAQ-Bereich finden, wenden Sie sich gerne jederzeit an IDEXX Laboratories. Sie erreichen uns unter der Nummer 069 153 253 290. Unsere Medizinische Fachberatung steht Ihnen für die Beratung bezüglich der labordiagnostischen Untersuchungen sowie Beurteilung Ihrer Laborergebnisse - ob Hund, Katze, Heimtier, Pferd oder Nutztier - gerne zur Verfügung.
Darüber hinaus kann unser Laborservice Ihnen bei allgemeinen Informationsfragen behilflich sein, die unter anderem auch die Einsendung der Proben betreffen.
Informationen zu unserem Kurierservice finden sie hier
.
Thrombozytenaggregate entstehen während der Blutabnahme, der Aufbewahrung im EDTA-Röhrchen oder während der Vorbereitung eines Blutausstrichs. Diese Verklumpungen sind das Ergebnis der natürliche Adhäsionsneigung der Thrombozyten. Hierbei handelt es sich also um „Artefakte“, da sie nicht im Blutkreislauf des Patienten zirkulieren. Die Verklumpung spielt bei der Beurteilung der Thrombozytenzahl eine wichtige Rolle. Wenn die Thrombozyten in der Probe nicht gleichmäßig verteilt sind, kann die ermittelte Anzahl niedriger ausfallen als die tatsächliche. Bei IDEXX untersuchen unsere Labormitarbeiter einen Blutausstrich bei signifikant abnormen Ergebnissen bei der automatisierten Zellzählung, um die Befunde zu verifizieren und vorhandene Blutplättchenklumpen zu notieren.
Thrombozytenaggregate können minimiert werden, indem während der Blutentnahme eine saubere Kanüle benutzt wird, das Blut sofort in das EDTA-Röhrchen gefüllt und die Probe vorsichtig gemischt wird. Manchmal reichen diese Maßnahmen jedoch nicht aus, um eine Verklumpung der Thrombozyten zu vermeiden. Wenn das Blut eines Patienten regelmäßig zu viele Thrombozytenaggregate aufweist, um die korrekte Plättchenzahl zu bestimmen, kann eine Blutprobe in eine mit Heparin gespülte Spritze gezogen werden, bevor sie in das EDTA-Probengefäß gefüllt wird. Die Verklumpung der Thrombozyten kann ebenfalls vermindert werden, indem die Blutprobe, wenn möglich, aus der Jugularvene entnommen wird.
Ergebnisse anzeigen
So entgeht Ihnen nie wieder ein Testergebnis
- Die Befunde Ihrer Patienten erhalten Sie online über IDEXX VetConnect PLUS , per E-Mail und durch automatischen Download in Ihr Praxismanagementsystem oder per Fax.
- Mit der VetConnect PLUS App können Sie die Testergebnisse Ihrer Patienten sofort auf Ihrem iPhone oder Android-Smartphone aufrufen.
Schauen Sie die Befunde Ihrer Patienten in IDEXX VetConnect PLUS an
Bitte wenden Sie sich dazu gerne jederzeit an IDEXX. Sie erreichen uns unter der Nummer 069 153 253 290.
Unsere Medizinische Fachberatung steht Ihnen für die Beratung bezüglich der labordiagnostischen Untersuchungen sowie Beurteilung Ihrer Laborergebnisse - ob Hund, Katze, Kleintier, Pferd oder Nutztier - gerne zur Verfügung.
Darüber hinaus kann unsere Laborhotline Ihnen bei allgemeinen Informationsfragen behilflich sein, die unter anderem auch die Einsendung der Proben betreffen.
Zusätzliche Ressourcen
Einheitenrechner
Fachbereiche
Allergiediagnostik
In Zusammenarbeit mit GREER bietet IDEXX spezifische Allergietests für Hunde, Katzen und Pferde an, die verlässliche, schnelle und reproduzierbare Ergebnisse liefern. GREER ist einer der weltweit führenden Anbieter von Serumallergietests. Die Allergene von GREER genießen weltweit ein hohes Ansehen unter Tierdermatologen.
So verwendet z.B. der canine, monoklonale, auf einem Antikörper-Cocktail basierende ELISA (macELISA) eine Mischung aus drei monoklonalen Antikörpern, die spezifisch an die Fc-Region von IgE binden. Die Ergebnisse des macELISA sind reproduzierbar und vergleichbar mit denen des hochaffinen IgE-Rezeptor-basierten ELISA (humaner rekombinanter FcεR).
IDEXX bietet neben einem Screeningtest mehrere Bausteine mit den wichtigsten Allergenen an, damit der individuelle Patient nach seinen Bedürfnissen auf bis zu 35 Umweltallergene getestet werden kann.
Im Nutridexx Futtermittel-Allergietest wird auf 23 Allergene getestet.
Bei IDEXX werden alle Serumallergietests mit CCD-Blockern durchgeführt. Dies vermindert das Auftreten falsch-positiver Befunde.
Weitere Informationen
Allergenspezifische Immuntherapie (ASIT)
Unser Lieferant für die allergenspezifische Immuntherapie ist die Firma Nextmune .
Für die Immuntherapie können Sie einzelne Allergene selbst auswählen und zusammenstellen oder Mischungen gängiger Allergene verwenden. Tiere, die bereits in Behandlung sind, können problemlos umgestellt werden. Zum Erreichen der Erhaltungsdosis sind nur wenige Injektionen notwendig.
Für die Bestellung einer Immuntherapie benötigen wir ein unterschriebenes Rezept.
Bei Fragen bezüglich der Allergenauswahl und zur Vorgehensweise bei Umstellung von bereits in Behandlung stehenden Patienten hilft Ihnen gerne unsere medizinische Fachberatung unter Tel. 069 153 253 290 weiter.
In der Abteilung Analytische Chemie werden Spurenelemente v. a. Kupfer, Selen, Mangan, Jod, alle Schwermetalle sowie Bromid (therapeutisches Drugmonitoring) analysiert und Vitaminanalysen sowie Steinanalysen durchgeführt.
Spurenelemente
Eine ausreichende Spurenelementversorgung ist Grundvoraussetzung für ein gesundes Tier. Je nach Haltung, Fütterung und Nutzung des Tieres ist der Bedarf unterschiedlich. Die Spurenelementanalyse erfolgt bei IDEXX mit der modernsten Analytik und auf höchstem Niveau mit Induktiv gekoppeltem Hochfrequenzplasma-Emissionsspektrometrie (ICP-OES) und Induktiv gekoppeltem Hochfrequenzplasma-Massenspektrometrie (ICP-MS). Insgesamt können mehr als 27 Elemente aus den unterschiedlichsten Materialien auf Anfrage analysiert werden. Grundsätzlich werden die gängigen Spurenelemente aus Serum analysiert. Die Ausnahmen sind Kupfer beim Rind aus EDTA-, Heparin-Blut, Mangan beim Rind und Hund aus EDTA-, Heparin-Blut) und Blei bei allen Tierarten (EDTA-, Heparin-Blut). Spurenelemente aus Gewebeproben, wie Leberbioptate oder Muskelgewebe können ebenfalls untersucht werden. Diese Proben sollten nativ eingeschickt werden (bitte nicht in Natriumchlorid oder Formalin einschicken). Von Haaranalysen zur Überprüfung der Spurenelement-Versorgung wird generell abgeraten, da die Spurenelementkonzentrationen abhängig von Haarfarbe, Haarart (Deckhaar, Mähnenhaar), Haardicke und Wachstumsgeschwindigkeit sind.
Bromid - Therapeutisches Drugmonitoring
Kaliumbromid wird als Antiepileptikum v.a. beim Hund angewendet. Die therapeutische Serumkonzentration liegt bei einer Add-on-Therapie mit Bromid bei etwa 100-200 mg/dl. Die therapeutische Serumkonzentration liegt bei einer Monotherapie mit Bromid bei etwa 200-300 mg/dl. (Nelson RW, Couto CG. Innere Medizin der Kleintiere. 2006). Die Bromid-Analyse aus Serum/Plasma erfolgt mit ICP-MS. Da es sich hier um einen direkten Nachweis der Bromisotope Br 79 und Br 81 handelt, kann dieser Test nicht falsch negativ sein.
Die hohe Qualität der Untersuchungen bei IDEXX wird regelmäßig in Ringversuchen kontrolliert.
Vitaminanalysen
Vitamine sind lt. Definition wichtige Nahrungsinhaltsstoffe, die der Körper nicht selbst oder nicht in genügendem Umfang bilden kann. Vitamine greifen in den Stoffwechsel ein, unterstützen bestimmte Körperfunktionen und übernehmen Schutzfunktionen. Von daher sind sie für alle Lebewesen außerordentlich wichtig. Vitamine werden in wasser- und fettlösliche Gruppen eingeteilt; die wasserlöslichen Vitamine B1, B2, B6 müssen aus EDTA- oder Heparin-Blut analysiert werden. Die fettlöslichen Vitamine A, E, D können aus Serum oder Plasma gemessen werden. In einer Zeit, in der die Ergebnisse immer schneller erwartet werden, werden die Vitamine A, E, B1, B6 bei IDEXX routinemäßig mittels U-HPLC (Ultra High Performance Liquid Chromatography) analysiert. Vitamin D3, Vitamin D2 und Vitamin B2 erfolgt mittels HPLC (High Performance Liquid Chromatography).
Steinanalyse
Harn-, Blasen-, Nierensteine werden in der analytischen Chemie mit Infrarot (IR) - Spektroskopie durchgeführt. Durch die neueste analytische Methode, die ATR-Technik (Attenuated Total Reflection), können auch mikroskopisch kleine Sedimentsteinchen analysiert werden. Da es sich bei der IR-Spektroskopie um eine Molekülspektroskopie handelt, können auch „Feststoffe“ aller Art (sofern die Moleküle IR-aktiv sind) nachgewiesen werden. Somit sind auch "Exoten-Proben", wie Zahnsteine, oder Gallensteine, ebenfalls kein Problem. Die Proben für die Steinanalyse sollten trocken, und nicht in Flüssigkeit, wie Formalin, Natriumchlorid oder dest. Wasser eingeschickt werden. Grundsätzlich können auch Urinsedimente untersucht und analysiert werden. Allerdings ist eine Untersuchung nur sinnvoll, wenn der Urin nicht klar ist, da ansonsten kein hinreichendes Sediment zentrifugiert werden kann.
Die Mikrobiologie zählt zu den ältesten Bereichen in der Labordiagnostik. Die Grundprinzipien haben bis heute Bestand, doch gleichzeitig gab es viele Weiterentwicklungen. So werden für die Keimidentifizierung und Resistenztestung inzwischen moderne Analysegeräte mit großen Datenbanken verwendet.
Bakteriologische Untersuchung und Erstellung eines Antibiogramms bei IDEXX
Die Untersuchung und Validierung der mikrobiologischen Proben erfolgt durch ein Team von erfahrenen Labormitarbeitern, geleitet von Dr. Peter Kopp und Dr. Ivonne Stamm, beide Fachtierärzte für Mikrobiologie, sowie Dipl. Biol. Andreas Margull, Mikrobiologe. Je nach Art der Probe, deren Lokalisation, Tierart sowie Vorbericht werden mehrere feste und/oder flüssige Medien beimpft, gefolgt von einer Bebrütung bei entsprechender Temperatur und Atmosphäre. Bei einigen Erregern werden bei Verdacht auch Selektivnährmedien ausgewählt, sowie in den meisten Fällen auch eine Anreicherungskultur mitgeführt. Wo sinnvoll, erfolgt zusätzlich eine Färbung des Probenmaterials.
Die Identifizierung von Bakterien und Pilzen erfolgt schon seit vielen Jahren mit der sehr spezifischen Methodik des MALDI Biotyper mittels Massenspektrometrie. Durch die integrierte Referenzdatenbank ist eine sehr zuverlässige und zudem schnelle Bestimmung der Mikroorganismen möglich. Diese Datenbank wird IDEXX-intern stetig durch zusätzliche veterinärmedizinisch relevante Referenzspektren aus unserem weltweiten Labornetzwerk ergänzt.
Ein valides Ergebnis erfordert mindestens zwei Arbeitstage (Ausnahme: Urinproben, ggf. nur ein Tag); sollte eine weitere Inkubation, Anreicherung oder Subkultivierung notwendig sein, kann sich dies verzögern. Auch ein sicher negatives Ergebnis erfordert bei manchen Keimen eine längere Kultur. Befundet werden ausschließlich pathogene bzw. fakultativ pathogene Erreger.
Für die Erstellung von Antibiogrammen nutzt IDEXX den VITEK®2, der eine stabile und automatisierte Testdurchführung sowie Abgleich der erhaltenen Ergebnisse mit einer komplexen Referenzdatenbank ermöglicht. Die Resistenzbestimmung erfolgt bei diesen Geräten mittels automatisiertem Mikrodilutionsverfahren basierend auf der MHK-Bestimmung (minimale Hemmkonzentration) inkl. interner Wachstumskontrolle und Überprüfung der Reinkulturen. Detektierte Resistenzphänotypen werden ebenfalls automatisch mitberücksichtigt. Die Auswahl der Antibiotika erfolgt in Abhängigkeit vom jeweiligen Keim und nach tiermedizinischen Kriterien. Die Interpretation der Ergebnisse (sensibel, intermediär, resistent) richtet sich nach international anerkannten Standards (Clinical and Laboratory Standard Institute/CLSI) für die jeweilige bakterielle Spezies bzw. Gruppe. Gemäss diesen Standards können Antibiogramme nicht erstellt werden für Keime, für die keine Auswertedaten (Grenzwerte) zur Verfügung stehen, oder für die in den Standards die Mikrodilution nicht zugelassen ist (betrifft z. B. fast alle anaeroben Bakterien). Alternativ ist bei einigen Keimen die Erstellung eines Antibiogramms mittels Agargeldiffusionsmethode möglich (CLSI).
Leitfaden für die Interpretation der minimalen Hemmkonzentration (MHK)
Pauschalpreise für bakteriologische Untersuchungen
Kennen Sie schon unsere Pauschalpreisoption für viele bakteriologische Untersuchungen? Bereits bei einer Keimdifferenzierung mit Antibiogramm ist der Pauschalpreis günstiger als eine bakteriologische Untersuchung + Keimdifferenzierung + Antibiogramm als einzelne Posten. In unserer Preisliste finden Sie weitere Informationen hierzu.
Die Pauschalpreisoption können Sie auch bei Abrechnung über den Tierhalter nutzen. Hierfür wird gemäß unseren allgemeinen Geschäftsbedingungen zusätzlich zum Nettopreis die Mehrwertsteuer sowie eine Bearbeitungsgebühr berechnet.
Gerne hilft Ihnen auch Ihr zuständiger Außendienstmitarbeiter oder unsere medizinische Fachberatung weiter.
Informationen zu den bakteriologischen sowie allen weiteren Untersuchungen von IDEXX finden Sie stets aktuell in unserem Online-Leistungsverzeichnis .
Die PCR (Polymerase Chain Reaction/Polymerase-Kettenreaktion) ermöglicht den empfindlichen Nachweis geringster Antigen-Konzentrationen im Patientenmaterial durch in vitro-Vermehrung definierter DNA- bzw. RNA-Genabschnitte.
Vorteile der real time-PCR gegenüber der konventionellen PCR
Während bei der konventionellen Methode die amplifizierte DNA über eine Gelelektrophorese weiter prozessiert werden muss, um den DNA-Abschnitt sichtbar zu machen, laufen in einem real time-PCR-Test Amplifikation und Detektion im gleichen Reaktionsgefäß ab. Das geschlossene System reduziert somit Kontaminationen auf ein Minimum. Der wesentliche Vorteil der real time-PCR gegenüber der konventionellen PCR ist zudem die Möglichkeit, die Messdaten quantitativ zu bewerten.
Sind entsprechende wissenschaftliche Erkenntnisse vorhanden, ist es z. B. möglich, über eine Quantifizierung der Krankheitserreger-Nukleinsäuremenge den Infektionsstatus eines Tieres in Kombination mit serologischen Daten genau zu bestimmen (z. B. Leishmaniose) oder die Beteiligung am Krankheitsgeschehen zu beurteilen (z.B. Clostridium perfringens Toxin-Gene).
Kombinieren Sie PCR und Serologie
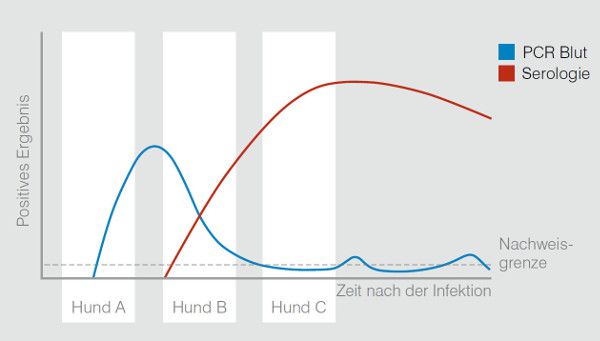
Der Zeitpunkt des Auftretens von Symptomen nach einer Infektion ist individuell und abhängig vom Erreger verschieden. Optimal ist deshalb eine Kombination von PCR und Serologie, insbesondere wenn der Zeitpunkt einer möglichen Infektion nicht bekannt ist.
- Hund A: kurz nach der Infektion. Der Hund kann Symptome zeigen. Im Blut ist Antigen vorhanden und kann mittels PCR detektiert werden. Bisher erfolgte keine Immunreaktion, die Serologie ist aus diesem Grund negativ.
- Hund B: zeigt Symptome. Das Ergebnis der PCR ist positiv, obwohl die Antigenmenge im Blut bereits abnimmt. Die Serologie ist durch eine ausreichende Immunantwort ebenfalls positiv.
- Hund C: chronische Erkrankung. Seit der Infektion sind Wochen bis Jahre vergangen. Der Hund kann symptomfrei sein. Die Serologie ist positiv, die PCR negativ, da kein freies Antigen mehr im Blut zirkuliert.
Die Zeitleiste der Erregernachweise für vektorübertragene Erkrankungen zeigt die optimale Nachweismethode für diverse Erreger in den verschiedenen Stadien nach Exposition.
Zeitleiste der Erregernachweise
PCR-Staffelpreise für individuelle Profile
Stellen Sie sich individuelle Profile zusammen
Kennen Sie schon unsere PCR-Staffelpreise? Hiermit können Sie selbst maßgeschneiderte Profile für spezielle Fälle zusammenstellen und profitieren dabei automatisch von derselben Preisstaffelung wie bei unseren IDEXX RealPCR-Profilen. Eine Übersicht über alle Erregernachweise mittels PCR finden Sie in unserem Online-Leistungsverzeichnis unter "Kategorien".
Gerne beraten Sie auch die Tierärzte unserer medizinischen Fachberatung zur Auswahl der Tests.
Gesundheit & Sicherheit durch Hygiene
Das Hygienekonzept von IDEXX und Dr. Brill + Partner
Hygiene in der Tierarztpraxis richtig umsetzen – mit fachkundigen Partnern
Tollwut-Antikörper-Nachweis
Neben einem EU-Heimtierausweis, einer eindeutigen Kennzeichnung mittels Mikrochip und einer gültigen Tollwutimpfung benötigen Hunde, Katzen und Frettchen bei Reisen außerhalb der EU und zur Wiedereinreise aus sog. Drittländern meistens auch eine Bestätigung des Impferfolges durch den Nachweis von Antikörpern gegen das Tollwut-Virus gemäß EU Verordnung 576/2013. Dieser Nachweis muss in einem von der EU-Kommission zugelassenem Labor erfolgen.
Seit 2006 besitzt IDEXX diese Zulassung für den Nachweis von Antikörpern gegen das Tollwut-Virus mittels des Fluoreszenz-Antikörper-Virusneutralisationstestes (FAVN). Für die Anforderung dieser Untersuchung benötigen Sie ein nach EU-Vorgaben erstelltes Antragsformular, das Sie bei IDEXX bestellen oder oben auf dieser Seite unter "Antragsscheine" herunterladen können.
Wir möchten Ihnen ermöglichen, bei einem Titer für Anti-Tollwut-Antikörper, der nicht ausreichend hoch für internationale Bestimmungen ist, schnell reagieren zu können. Daher erhalten Sie Ergebnisse der Anti-Tollwut-Antikörperbestimmung von unter 0,5 IU/ml ausschließlich als regulären Laborbefund. Ein Titer ≥0,5 IU/ml nach Impfung ist entsprechend der WHO/O.I.E. Empfehlungen für das Reisen gemäß EU-VO 576/2013 und Pet Travel Scheme (PETS) ausreichend. In diesem Fall erhalten Sie ebenfalls vorab einen Laborbefund und wie gewohnt zusätzlich das Zertifikat per Post.
Weitere Informationen, was bei Reisen mit Heimtieren beachtet werden sollte, finden Sie auch in unserem:
Vet Med Update "Nachweis von Antikörpern gegen das Tollwut-Virus bei Hund, Katze und Frettchen"
Anforderung
Bitte beachten Sie bei der der Anforderung eines Tollwut-Antikörper-Nachweises bei IDEXX unbedingt Folgendes:
- Verwendung des speziellen Anforderungsformulars für den Tollwut-Antikörper-Nachweis (jetzt auch als ausfüllbares PDF verfügbar)
- korrektes und vollständiges Ausfüllen des Formulars inklusive Stempel und Unterschrift des/der Tierarztes/ärztin, Microchipnummer und Datum der letzten Impfung.
- benötigtes Material: 1 ml Serum von guter Qualität (kein gerinnungsgehemmtes, hämolytisches und/oder lipämisches Blut)
- eindeutige Kennzeichnung des Probenröhrchens (s. Anforderungsformular)
- Untersuchungsdauer: 3–10 Tage
Bei Einsendung aus nicht-europäischen Ländern muss in den Versandpapieren und außen auf dem Päckchen deutlich vermerkt sein, dass es sich um eine Probe für den Tollwut-Antikörper-Nachweis handelt.
Aktuelle Informationen und rechtliche Grundlagen rund um das Reisen mit Hund, Katze und Frettchen finden Sie auch auf der Internetseite des Bundesministeriums für Ernährung und Landwirtschaft .
Bei Fragen steht Ihnen unsere tierärztliche Fachberatung gerne unter Tel: 069 153 253 290 zur Verfügung. Alternativ schicken Sie Ihre Anfrage bitte per E-Mail an rabies@idexx.com .
Auch Anfragen bezüglich der Echtheit von Zertifikaten gemäß Durchführungsverordnung (EU) 2016/561 vom 11.04.2016 beantworten wir Ihnen gerne unter rabies@idexx.com . Bitte geben Sie die Labornummer mit an.
Please send requests regarding the authenticity of our certificates (COMMISSION IMPLEMENTING REGULATION (EU) 2016/561 of 11 April 2016) with our lab number to rabies@idexx.com .
IDEXX verfügt über das größte globale Netzwerk an anatomischen und klinischen Pathologen/innen, die Ihnen bei klinischen Entscheidungsprozessen mit ihrem Fachwissen zur Seite stehen. Durch die Digitalisierung der histologischen Präparate können bei Bedarf Experten/innen im weltweiten IDEXX-Netzwerk konsultiert werden. Gleichzeitig ist uns der Service vor Ort für unsere Kunden wichtig. So können Sie telefonisch oder per E-Mail den Rat des/der Pathologen/in, der/die Ihrem Fall zugewiesen wurde, erhalten.
Histologische Untersuchung von endoskopischen Magen-Darm-Biopsien
Die histologische Untersuchung auf entzündliche Infiltrate, morphologische Veränderungen und Krankheitserreger in der Magen- und Darmschleimhaut ist ein wichtiger Baustein in der Diagnostik bei Patienten mit chronischer gastrointestinaler Symptomatik. Ein therapeutischer Effekt kann hiermit auch bei persistierender Klinik erkannt werden. Die bei subjektiven histologischen Einschätzungen relativ lose Korrelation zwischen histopathologischen Befundergebnissen und klinischem Bild kann durch das von der World Small Animal Veterinary Association (WSAVA 2008)1 entwickelte und durch Jergens et al. (2014)2 modifizierte standardisierte pathologische Befundsystem deutlich erhöht werden. Hierbei erfolgt ein definiertes Grading der morphologischen Veränderungen und der Anzahl an Entzündungszellen in jedem Abschnitt des Magendarmkanals. Bei adäquater Probenentnahme (Schleimhaut vollständig enthalten, ausreichende Probengröße und -menge, umgehende Fixation) ergibt sich hieraus der zusätzliche Vorteil der Vergleichbarkeit der Befunde von Proben, die zu unterschiedlichen Krankheitszeitpunkten entnommen wurden.
Ausführliche Informationen haben wir in unserem Diagnostic Update "Endoskopische Biopsien bei Hunden" für Sie zusammengestellt.
Histologische Untersuchung von Lebergewebe
IDEXX bietet Ihnen eine umfassende histopathologische Beurteilung von Leberbiopsien. Die wesentlichen Merkmale der Beurteilung von Leberbiopsien sind Art und Grad der Entzündung, Leberzellschädigung oder Zelltod, Pigmentablagerungen und das Vorhandensein möglicher angeborener Missbildungen. Zu diesem Zweck werden neben der Hämatoxilin und Eosin (H&E)-Färbung eine Reihe weiterer histochemischer Spezialfärbungen eingesetzt. Insbesondere eine Spezialfärbung zur Visualisierung von Kupfereinlagerungen ist wichtig und ermöglicht ein semiquantitatives Scoring, das eine gute Korrelation mit quantitativen Kupferbestimmungen zeigt. Dieser Nachweis wird benötigt um eine Kupfer-assoziierte Chronische Hepatitis (CH) zu diagnostizieren. Leberbiopsien werden typischerweise entnommen, um die Diagnose einer CH zu stellen. Damit die Einteilung der CH standardisiert erfolgen kann wird ein Scoring System genutzt, das durch die WSAVA empfohlen wird und dafür bestimmt ist sowohl Biopsien vor dem Behandlungsbeginn als auch im Behandlungsverlauf zu untersuchen, um hier den Behandlungseffekt abschätzen zu können. Dieses Scoring System beruht auf der Bewertung der Entzündungsqualität, -quantität, -lokalisation sowie dem Grad der Fibrose, den Strukturveränderungen und ggfls. der Entwicklung einer Zirrhose.
Ausführliche Informationen haben wir in unserem Diagnostic Update "Leberbiopsien beim Hund als hilfreiches Diagnostikinstrument für Prognose und Behandlung der chronischen Hepatitis" für Sie zusammengestellt.
Maulhöhlenprofil Katze
Erkrankungen der Maulhöhle bei Katzen werden häufig während Routineuntersuchungen beobachtet. Die häufigsten chronischen Erkrankungen der Maulhöhle sind entweder entzündlicher oder neoplastischer Natur. Dabei ist hervorzuheben, dass insbesondere Tumoren in der Maulhöhle von Katzen eine maligne Dignität aufweisen. Die Berücksichtigung dieser Faktoren hilft beim Management solcher Patienten und der Erwartungen der Besitzer.
Unter den chronischen entzündlichen Erkrankungen der Maulhöhle ist die feline chronische Gingivostomatitis (FCGS) eine der wichtigsten Differentialdiagnosen, die regelmäßig eine Herausforderung in der Therapie betroffener Katzen darstellt.
Das Maulhöhlenprofil Katze hat den Testcode HISTFE und beinhaltet eine Histopathologische Untersuchung sowie PCR-Untersuchungen auf das feline Calicivirus und das feline Herpesvirus 1. Die Option "Eilige Bearbeitung histopathologischer Proben" ist verfügbar.
Ausführliche Informationen haben wir in unserem Diagnostic Update "Feline chronische Gingivostomatitis (FCGS) - Häufige klinische Befunde, diagnostisches Vorgehen und Therapien" für Sie zusammengestellt.
Ophthalmologische Pathologie
Präparation und spezielle histopathologische Untersuchung des Augapfels. Ophthalmologische Pathologie erfordert besondere Kenntnisse, um subtile anatomische und histologische Läsionen erkennen zu können. Bitte benutzen Sie den Testcode HISTOC für Einsendung von Augäpfeln von Kleintieren und HISTOCL für die von Großtieren. Je nach Verfügbarkeit der Spezialisten erfolgt die Befundung in deutscher oder englischer Sprache.
Eilige Bearbeitung von histologischen Proben
Seit dem 01.01.2021 können Sie bei IDEXX zwischen zwei Optionen für die Histopathologie wählen. Zusätzlich zur regulären histopathologischen Untersuchung bieten wir gegen Aufpreis eine bevorzugte Bearbeitung dringender Proben an. Die Bearbeitungszeit beträgt dabei 1 – 3 Werktage ab Eingang der Probe im Labor (regulär 3 – 5 Werktage Untersuchungsdauer). Die Option ist für die Histopathologische Untersuchung (Testcodes HISTU, HISTU3, HISTU9) sowie für die Histologische Untersuchung von endoskopischen Magen-Darm-Biopsien (Hund/Katze) (Testcode HISTGI), das Maulhöhlenprofil (Katze) (HISTFE) sowie die histopathologische Untersuchung der Haut (HISTS) verfügbar. Diese Untersuchungen sind in der Preisliste mit einem Stoppuhrsymbol kenntlich gemacht. Sticker für die Kenntlichmachung von Proben für diesen Service können Sie über unser Online-Bestellportal oder die Bestellannahme für Probenversandmaterial bestellen.
Literatur
- Day MJ, Bilzer T, Mansell J, et al. Histopathological standards for the diagnosis of gastrointestinal inflammation in endoscopic biopsy samples from the dog and cat: a report from the World Small Animal Veterinary Association Gastrointestinal Standardization Group. J Comp Pathol. 2008;138 Suppl 1:S1-S43.
- Jergens, AE, Evans, RB, Ackermann, M. Design of a simplified histopathologic model for gastrointestinal inflammation in dogs. Vet Pathol. 2014;51(5):946–950.
Weitere Informationen zu Tests, Artikel und Diagnostikressourcen